Programm | Impressionen | Galerie
Impressionen des Jahrestreffens 2019
|
Als Gastsprecher unseres bio-N3MR Netzwerktreffens 2019 in Jülich konnten wir Prof. Jochen Balbach gewinnen. Er ist Inhaber des Lehrstuhls Biophysik und medizinische Physik am Institut für Physik der Martin-Luther-Universität Halle-Wittenberg. Jochen Balbach ist einer der Pioniere bei der experimentellen Charakterisierung von Proteinfaltungsprozessen mittels hochauflösender NMR-Spektroskopie. Heute verwendet seine AG ausgeklügelte NMR-Methoden und biophysikalische Ansätze, um den Einfluss von Druck, Temperatur und weiteren Parametern auf die Kinetik der Proteinfaltung und –aggregation zu studieren sowie die Struktur und Dynamik medizinisch relevanter Proteine zu charakterisieren. Kürzlich wurde Prof. Rasmus Linser auf den neu etablierten Lehrstuhl für Biomolekulare NMR-Spektroskopie an der TU Dortmund berufen. Dort entwickelt er innovative Methoden, insbesondere auf dem Gebiet der 1H detektierten Festkörper-NMR-Spektroskopie und setzt diese zur Untersuchung komplexer biologischer Fragestellungen ein. Rasmus Linser und seine Arbeitsgruppe nahmen erstmals an einem Treffen des bio-N3MR Netzwerkes teil. |
Es folgen fotographische Eindrücke von der bio-N3MR Jahrestagung 2019:
 Im Mittelpunkt des Vortrags von Prof. Jochen Balbach stand das Parathyroidhormon (PTH). In einer teilweise strukturierten Form bindet und aktiviert dieses Peptid den zugehörigen G-Protein-gekoppelten Rezeptor. Im inaktiven Zustand wird es in der Zelle in Form vom Amyloidfibrillen gespeichert. Im Vortrag wurden neue Erkenntnisse zu beiden funktionalen Erscheinungsformen von PTH vorgestellt.
Im Mittelpunkt des Vortrags von Prof. Jochen Balbach stand das Parathyroidhormon (PTH). In einer teilweise strukturierten Form bindet und aktiviert dieses Peptid den zugehörigen G-Protein-gekoppelten Rezeptor. Im inaktiven Zustand wird es in der Zelle in Form vom Amyloidfibrillen gespeichert. Im Vortrag wurden neue Erkenntnisse zu beiden funktionalen Erscheinungsformen von PTH vorgestellt.
 Prof. Rasmus Linser stellte neue Konzepte zur Untersuchung großer Proteinkomplexe mittels Festkörper-NMR-Spektroskopie sowie erste Schritte und Ergebnisse bei deren Realisierung vor.
Prof. Rasmus Linser stellte neue Konzepte zur Untersuchung großer Proteinkomplexe mittels Festkörper-NMR-Spektroskopie sowie erste Schritte und Ergebnisse bei deren Realisierung vor.
 Dr. Ümit Akbey, Wissenschaftler in der Festkörper-NMR AG von Prof. Henrike Heise in Jülich, stellte verschiedene fibrillenbildende Proteine und deren Untersuchung mit Festkörper-NMR-Spektroskopie vor.
Dr. Ümit Akbey, Wissenschaftler in der Festkörper-NMR AG von Prof. Henrike Heise in Jülich, stellte verschiedene fibrillenbildende Proteine und deren Untersuchung mit Festkörper-NMR-Spektroskopie vor.
 Laetitia Heid, Doktorandin in der AG von Prof. Wolfgang Hoyer in Düsseldorf, stellte ihre Strategie zur Identifizierung amyloidogener β-Haarnadel Motive in Proteindatenbanken vor.
Laetitia Heid, Doktorandin in der AG von Prof. Wolfgang Hoyer in Düsseldorf, stellte ihre Strategie zur Identifizierung amyloidogener β-Haarnadel Motive in Proteindatenbanken vor.
 Alexander Klein, Doktorand in der AG von Prof. Rasmus Linser in Dortmund, verwendet die Methode des nicht-einheitlichen Sampling, um NMR-Spektren mit bis fünf Dimensionen aufzunehmen und damit das 72 kDa Protein Tryptophansynthase zu charakterisieren.
Alexander Klein, Doktorand in der AG von Prof. Rasmus Linser in Dortmund, verwendet die Methode des nicht-einheitlichen Sampling, um NMR-Spektren mit bis fünf Dimensionen aufzunehmen und damit das 72 kDa Protein Tryptophansynthase zu charakterisieren.
 Dr. Christine Beuck, Wissenschaftlerin in der AG von Prof. Peter Bayer in Essen, berichtete über die Herausforderungen bei der Strukturbestimmung der PUB-Domäne des „UBX domain containing protein 1“ (UBXD1) mit Lösungs-NMR-Spektroskopie.
Dr. Christine Beuck, Wissenschaftlerin in der AG von Prof. Peter Bayer in Essen, berichtete über die Herausforderungen bei der Strukturbestimmung der PUB-Domäne des „UBX domain containing protein 1“ (UBXD1) mit Lösungs-NMR-Spektroskopie.
 Mike Blüggel, Doktorand im Labor von Prof. Peter Bayer, setzt zur Aufklärung der strukturellen Basis der Erkennung von Ubiquitin durch UBXD1 zusätzlich zur NMR-Spektroskopie auf chemische Quervernetzung, massenspektroskopische Analysen und Modellierung.
Mike Blüggel, Doktorand im Labor von Prof. Peter Bayer, setzt zur Aufklärung der strukturellen Basis der Erkennung von Ubiquitin durch UBXD1 zusätzlich zur NMR-Spektroskopie auf chemische Quervernetzung, massenspektroskopische Analysen und Modellierung.
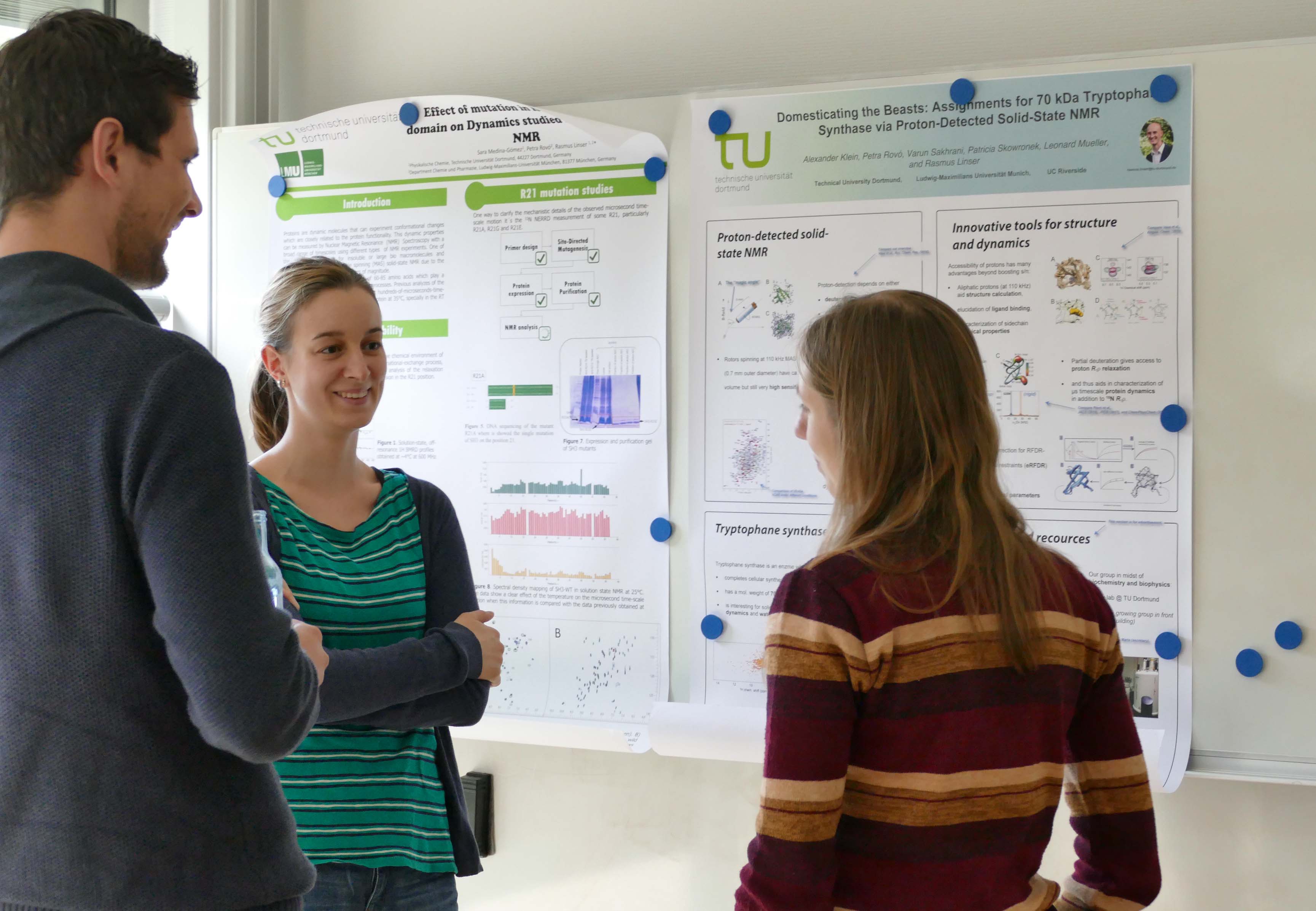 Die Kaffeepause wurde zum Kennenlernen und Fachsimpeln genutzt.
Die Kaffeepause wurde zum Kennenlernen und Fachsimpeln genutzt.
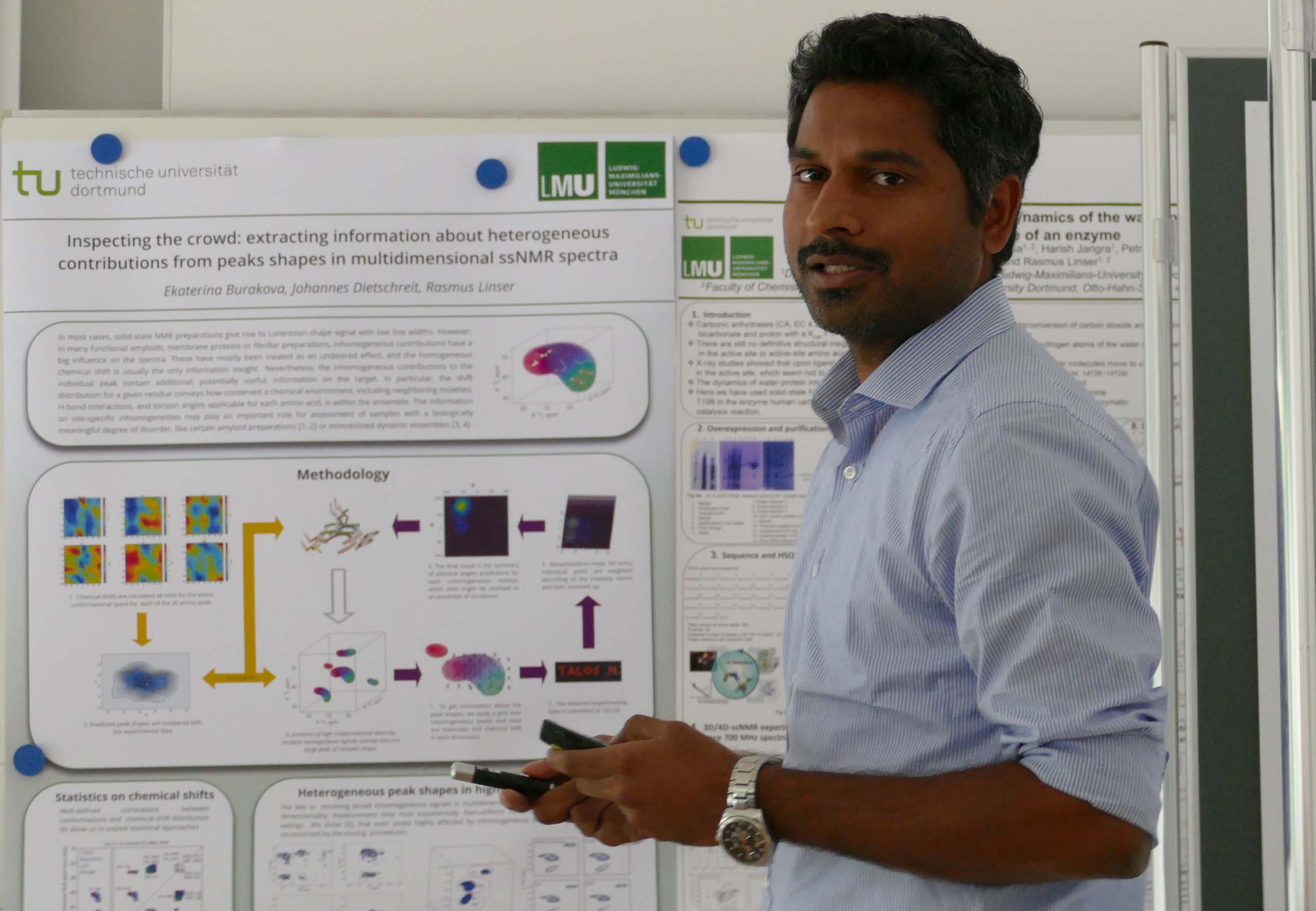 Dr. Mohanraj Gopalswamy, Postdoc in der Gruppe von Prof. Holger Gohlke arbeitet an einem Kooperationsprojekt mit Dr. Manuel Etzkorn (Düsseldorf). Mohanraj stellte seine Ergebnisse zur Inhibierung der Homo-Tetramerisierung des onkogenen Proteins AML1-ETO durch spezifische Liganden vor.
Dr. Mohanraj Gopalswamy, Postdoc in der Gruppe von Prof. Holger Gohlke arbeitet an einem Kooperationsprojekt mit Dr. Manuel Etzkorn (Düsseldorf). Mohanraj stellte seine Ergebnisse zur Inhibierung der Homo-Tetramerisierung des onkogenen Proteins AML1-ETO durch spezifische Liganden vor.
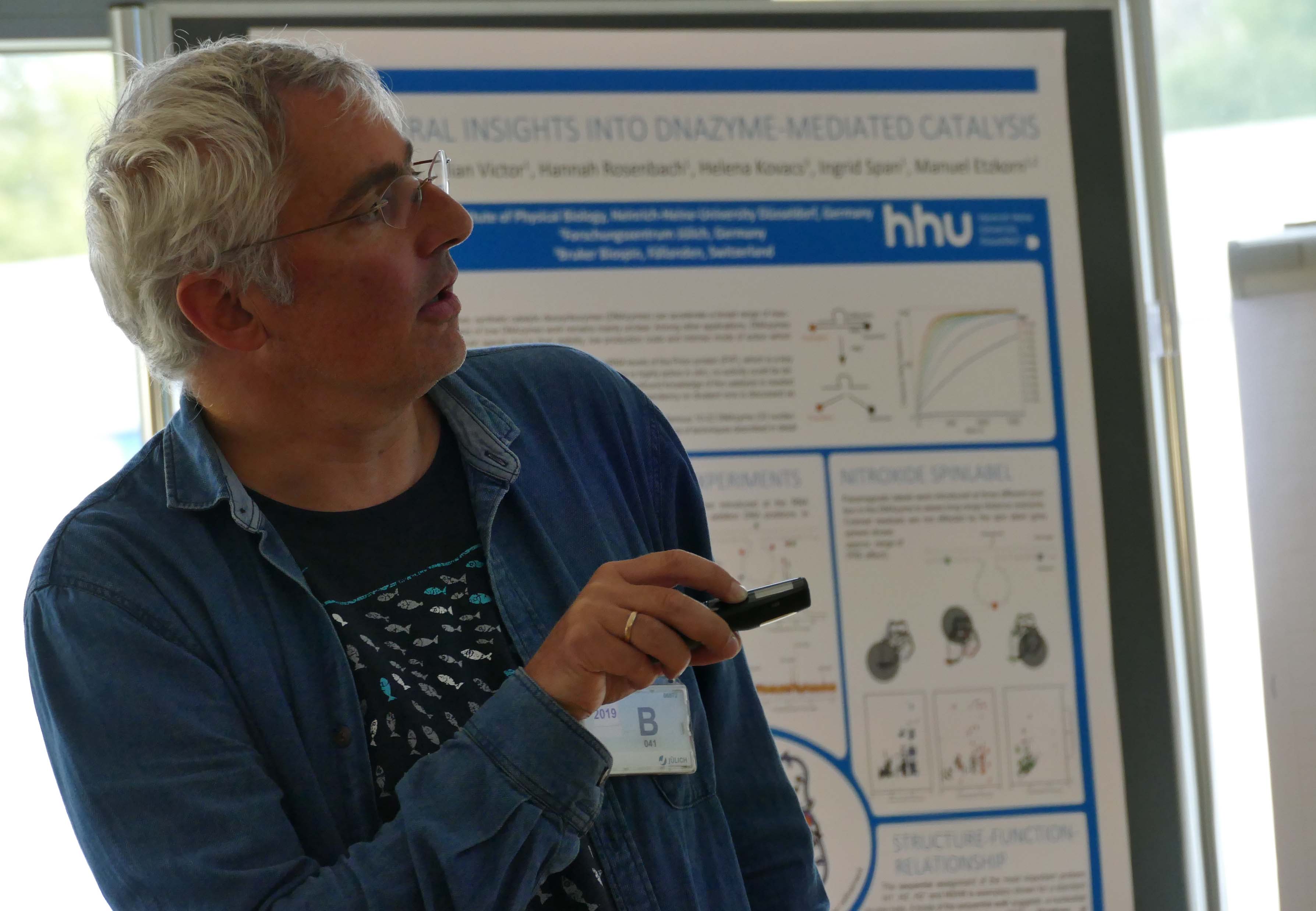
 Jan Borggräfe, Doktorand in der AG von Dr. Manuel Etzkorn, berichtete über den Fortschritt seiner Experimente zur Aufklärung grundlegender Aspekte der DNA-vermittelten Katalyse.
Jan Borggräfe, Doktorand in der AG von Dr. Manuel Etzkorn, berichtete über den Fortschritt seiner Experimente zur Aufklärung grundlegender Aspekte der DNA-vermittelten Katalyse.
 Irina Apanasenko, Doktorandin in der AG von Dr. Philipp Neudecker (Düsseldorf), untersucht die Dynamik des membranassoziierten Autophagieproteins GABARAP mit Lösungs-NMR-Spektroskopie. Sie stellte ihre Strategie zur Herstellung des dreifach isotopenmarkierten GABARAP und erste NMR-Ergebnisse vor.
Irina Apanasenko, Doktorandin in der AG von Dr. Philipp Neudecker (Düsseldorf), untersucht die Dynamik des membranassoziierten Autophagieproteins GABARAP mit Lösungs-NMR-Spektroskopie. Sie stellte ihre Strategie zur Herstellung des dreifach isotopenmarkierten GABARAP und erste NMR-Ergebnisse vor.
 Das Symposium klang am Abend mit einem gemeinsamen BBQ aus.
Das Symposium klang am Abend mit einem gemeinsamen BBQ aus.
 English
English
